Introdução
O Brasil é um país conhecido por sua vasta biodiversidade distribuída entre seis biomas: Amazônia, Caatinga, Cerrado, Mata Atlântica, Pampa e Pantanal. Esses, por sua vez, são regiões extensas — milhares de quilômetros quadrados (km²) — com características físicas (como solo e altitude), clima, hidrografia, fauna, flora e tipos de vegetação (fitofisionomias) distintas entre si e relações peculiares entre os seres vivos que os habitam.[1]
Como são muito extensos, ainda é possível identificar diversos tipos de vegetação em um mesmo bioma. Contudo, os limites entre biomas e tipos de vegetação são fluidos e há misturas nas regiões de contato, ou seja, plantas de um bioma podem aparecer em outro, assim como animais transitam entre eles. Há também algumas espécies (animais e vegetais) de ocorrência exclusiva – as chamadas endêmicas. As espécies vegetais, por sua vez, representam um importante habitat para os microrganismos endofíticos (Figura 1).
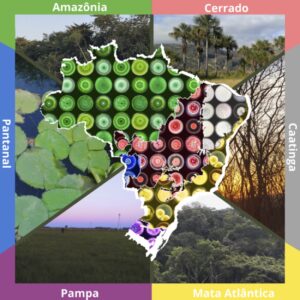
Figura 1. Representação dos biomas brasileiros e fungos endofíticos isolados
(Produção dos autores)
Microrganismos e suas interações
Um aspecto interessante dos microrganismos é sua grande diversidade, a qual tem sido cada vez mais explorada, visto que sua importância para o funcionamento de ecossistemas se torna mais evidente. Eles interagem com o meio ambiente e desempenham inúmeras funções, atuando na degradação de produtos naturais complexos (como a lignina) e substâncias sintéticas (pesticidas e corantes), participando em ciclos biogeoquímicos, fluxo de energia e nutrientes.[2,3]
Em seus nichos ecológicos, os microrganismos também podem estabelecer uma série de relações ecológicas com outros organismos, incluindo espécies vegetais. Essas relações podem ser desarmônicas, onde pelo menos um dos organismos é afetado negativamente; neutra, onde nenhum dos organismos envolvidos é afetado; e harmoniosa, onde pelo menos um dos organismos é beneficiado.[2] Um exemplo é a relação ecológica encontrada entre um fungo endofítico e sua planta hospedeira: o fungo coloniza o interior do tecido vegetal sem causar sintoma de doença e auxilia direta e indiretamente nos processos biológicos e fisiológicos de sua planta hospedeira.
“Os microrganismos são parte essencial da vasta biodiversidade brasileira e muitos estão adaptados para viver em associações simbióticas com outros organismos.”
Os mecanismos de interação fungos endofíticos-plantas hospedeiras são complexos e evoluíram ao longo do tempo de coexistência destes organismos. Assim, a secreção de compostos químicos pela planta atrai os fungos e dá-se início ao processo de colonização com a secreção de enzimas e metabólitos especializados para driblar os mecanismos de defesa da planta.[4] Além dos fungos endofíticos, os fungos micorrízicos, as rizobactérias e bactérias endofíticas também tem sido alvo de estudos.[2]
Fungos endofíticos
Fungos endofíticos são microrganismos que, durante parte ou todo o seu ciclo de vida, residem no interior dos tecidos vegetais (frutos, flores, folhas, caules, raízes e sementes) sem causar qualquer dano aparente à planta hospedeira. Essa oferece ao fungo um habitat estável com baixas variações nas condições ambientais (umidade, pH, temperatura) e nutrientes (açúcares e aminoácidos) enquanto o fungo produz compostos que podem auxiliar nas funções fisiológicas e ecológicas das plantas, promovendo o crescimento, aumentando sua aptidão em condições de temperaturas extremas, seca, salinidade e protegendo-a de insetos, herbívoros e patógenos.[2,3]
O micobioma endofítico, conjunto de espécies fúngicas que colonizam os tecidos internos dos vegetais, varia em função da espécie hospedeira, tipo de tecido/órgão, condições ambientais, idade da planta e interações com outros organismos (Figura 2); ou seja, é dinâmico e apresenta ampla plasticidade taxonômica e funcional.
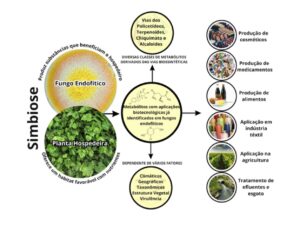
Figura 2. Interação fungo endofítico/planta hospedeira e exemplos de aplicações de metabólitos produzidos por esses microrganismos.
(Produção dos autores)
Fungos endofíticos distribuídos entre os biomas brasileiros
Amazônia
No passado, a Amazônia cobria em torno de 50% do Brasil; entretanto, por volta de 18% da área original já foi desmatada.[1] Está situada na região Norte do país, numa área de baixa altitude, alta umidade e altos índices pluviométricos (ou seja, chove muito). Grande parte dela tem uma vegetação bem fechada.[1] Possui mais de 14.500 espécies vegetais catalogadas em suas diferentes fitofisionomias.[5]
Estudos dos seus microrganismos são ainda tímidos se comparado aos seus potenciais biodiverso, sendo os destaques para os organismos macroscópicos, os conhecidos cogumelos, usados no desenvolvimento social e econômico da região.[6] Há poucos relatos sobre os fungos endofíticos. O extrato do fungo endofítico Aspergillus sp., isolado das amêndoas de Bertholletia excelsa Humn & Bonlp, demonstrou potencial atividade larvicida contra Aedes aegypti, mosquito vetor da dengue.[7] Novos metabólitos foram isolados do fungo Diaphorte sp.[8] e, ainda, metabólitos com potencial atividade antimicrobiana, e produção de enzimas hidrolíticas para a degradação de biofilme de Staphylococcus aureus.[9]
Caatinga
A Caatinga correspondia a mais ou menos 11% do país, localizada na região Nordeste. Tem um clima semiárido, com chuvas irregulares e uma média de precipitação de 620 mm por ano, com grande variação em torno dessa média.[1] A Caatinga tem por volta de 6.300 espécies vegetais já catalogadas e perdeu por volta de 42% de sua área.[5]
“Os biomas brasileiros, por possuírem elevado número de espécies vegetais e características ambientais únicas, são notáveis reservatórios de uma diversidade de fungos endofíticos, incluindo espécies novas e com potencial para aplicações biotecnológicas.”
A diversidade de fungos endofíticos desse bioma tem sido investigada, com a descrição de novas espécies, como Diaporthe caatingaensis e Toxicocladosporium cacti, isoladas de cactos da Caatinga. Novidades taxonômicas tem sido descrita por pesquisadores da Universidade Federal de Pernambuco (UFPE) e da Universidade Federal de Goiás (UFG), destacando o potencial de novas espécies do bioma. Além do inventário da diversidade de fungos, há interesse no potencial biotecnológico dos endófitos, seja para produção de enzimas (inclusive anticancerígena) e antimicrobianos (contra bactérias e fungos patogênicos humanos, animais e de plantas).[10,11] Outras espécies de plantas da Caatinga têm sido estudadas, verificando-se uma grande diversidade de fungos com potencial biotecnológico e ressaltando a importância de conservação do bioma para a descoberta de possíveis serviços ecossistêmicos.[10,11]
Cerrado
O Cerrado ocupava em torno de 24% do país, no chamado Planalto Central. Possui uma estação chuvosa e uma seca bem definidas, localiza-se em altas altitudes e sua vegetação está dividida entre as florestais, as savânicas e as campestres.[1] Grande parte do bioma está adaptada ao fogo, sendo comum árvores com cascas espessas ou plantas capazes de rebrotar das raízes após a queima (dentre outras adaptações).[12] O Cerrado faz fronteira com quase todos os biomas do país, exceto o Pampa. Nele, foram catalogadas mais de 13.900 espécies vegetais.[5] É um dos dois biomas brasileiros considerados hotspot[13] de biodiversidade (Mata Atlântica é o outro), assim definido por possuir grande número de espécies, mas, ao mesmo tempo, ser fortemente ameaçado pelas atividades humanas. Hoje, aproximadamente 52% desse bioma já foi perdido, principalmente devido à agropecuária.[5]
Nesse bioma, as pesquisas visam caracterizar o micobioma endofítico de espécies nativas, isolado de distintas partes vegetais. Como resultado, foi encontrada ampla diversidade de espécies de fungos endofíticos, sendo algumas ainda não catalogadas. Através de abordagens dependentes e independentes de cultura (utilizando metabarcoding), verificou-se o micobioma endofítico foliar de seis espécies nativas do Cerrado, incluindo uma de suas espécies símbolo, Caryocar brasiliense (Pequi), indicando que a colonização ocorre não por uma única espécie fúngica, mas por um conjunto de espécies.[14]
Ainda, se destaca a importância desses microrganismos em funções ecossistêmicas que envolvem fluxo de energia e ciclagem de nutrientes e na aptidão e adaptação das plantas hospedeiras sob condições de estresse;[14] além de estudos de avaliação do potencial bioativo dos metabólitos produzidos, com destaque para os anticancerígenos[15] e antimicrobianos (inclusive capazes de inibir bactérias multirresistentes), como, por exemplo, a nova espécie Diaporthe cf. heveae.[16]
Mata Atlântica
A Mata Atlântica cobria em torno de 17% do país, estando presente em 17 estados, abrangendo todo o litoral e áreas dos estados de Minas Gerais, Mato Grosso do Sul e Goiás. Presente em região montanhosa, abrange uma faixa grande, de Sul a Norte do país, com uma grande variedade de ambientes[1] e já foram catalogadas mais de 21.200 espécies vegetais.[5] Esse é o bioma mais devastado do país, tendo perdido mais ou menos 70% da sua área original (hotspot brasileiro).[13]
Pesquisadores do Laboratório de Produtos Bioativos (LPBio) do Centro Multidisciplinar de Macaé – Universidade Federal do Rio de Janeiro (UFRJ) e colaboradores tem dedicado aos estudos de fungos endofíticos do ambiente da Restinga de Jurubatiba, um ecossistema rico em diversidade, presente no bioma da Mata Atlântica. Dentre os destaques, estão os fungos endofíticos associados às espécies vegetais Humiria balsamifera e Tocoyena bullata. Dessa última, a substância lasiodiplodina, produzida pelo fungo Sordaria tamaensis, apresentou relevante atividade frente a bactéria Mycobacterium tuberculosis, agente causador da tuberculose em humanos, atuando tanto como antimicobacteriano (capaz de inibir o crescimento de M. tuberculosis) como anti-inflamatório (capaz de reduzir danos relacionados ao processo inflamatório associados com a tuberculose).[17]
Outro destaque é a avaliação de atividades enzimáticas, por meio de processos de biotransformação, já que a descoberta de enzimas é útil em diversos setores, como indústrias têxteis, alimentos, medicamentos, química, biocombustível, entre outras. Nesse contexto, estão os fungos endofíticos Stemphylium lycopersici e Alternaria arborescens, isolados da planta Humiria balsamifera e o fungo Sordaria tamaensis, isolado da planta Tocoyena bullata, que têm sido bastante promissores para produção de enzimas lipases e transaminases, importantes na indústria química com enfoque na obtenção de substâncias úteis como medicamentos.[18-20] Os processos de biotransformação são importantes porque geram produtos e processos de maneira mais sustentável, contribuindo para a uma melhor conservação do ambiente: é o que chamamos de química verde.
Pesquisas envolvendo ecologia química e interações entre os fungos endofíticos com suas plantas hospedeiras também foram realizados,[21-24] indicando que essas interações são bastante complexas e equilibradas.
Pampa
O Pampa, situado na região Sul do país, ocupa uma área de 2.3% do Brasil com clima temperado e subtropical e sua vegetação é predominantemente campestre, composta principalmente por espécies de gramíneas.[1,5] Mas vale ressaltar novamente: há diferentes tipos de vegetação e, mesmo nesse bioma, é possível encontrar áreas com florestas.
Embora exista grande diversidade de plantas endêmicas e peculiaridades nesse bioma, há poucas pesquisas, até o momento, sobre a diversidade de microrganismos, em especial os endofíticos. Um estudo reportou cerca de 934 fungos de Ascomycota, 149 Basidiomycota e 58 Myxomycetes do Pampa brasileiro.[25] O trabalho realizado pelo Núcleo de Estudos da Vegetação Antártica da Universidade Federal do Pampa – UNIPAMPA investigou a biodiversidade e o potencial biotecnológico de fungos endofíticos. Fungos dos gêneros Fusarium, Colletotrichum, Diaporthe, Pestalotiopsis e Epicoccum foram isolados de uma herbácea bulbosa endêmica desse bioma, Kelissa brasiliensis (Baker) Ravenna – espécie considerada vulnerável devido ao avanço da agricultura[26,27] – e, testados quanto ao seu potencial antibacteriano. Outro destaque foi o endofítico Botryosphaeria dothidea, isolado de Solanum americanum, devido ao seu alto potencial na produção de compostos antioxidantes.[28]
Pantanal
O Pantanal ocupava por volta de 1.8% do país, sendo também conhecido como a “maior planície alagável do mundo”. Com baixas altitudes e um período seco e outro chuvoso, resultando em períodos de inundações e secas em certas regiões, caracterizando as planícies alagáveis (não é o Pantanal inteiro que alaga).[1] Já foram catalogadas mais de 1.800 espécies vegetais e aproximadamente 15% do bioma já foi desmatado.[5]
Características únicas do solo, como pH, composição de matéria orgânica e concentração de minerais podem afetar a abundância da microbiota endofítica associada às plantas desse bioma. Um estudo comparativo entre a microbiota endofítica do Pantanal e Cerrado mostrou que os fungos do primeiro apresentavam funções especializadas tanto para a síntese do ácido 3-indol acético (AIA), importante para desenvolvimento de raízes vegetais (favorecendo a absorção de nutrientes pela planta), como para antibiose (resultante na produção de antibióticos).[29]
As atividades antimicrobianas são outro destaque. O fungo Diaporthe sp. produziu extratos ativos frente a diferentes bactérias causadoras de doenças em humanos, como Klebsiella pneumonia e S. aureus resistente à meticilina (MRSA).[30] De Vochysia divergens, foi isolado Phaeophleospora vochysiae sp. Nov., uma nova espécie de fungo endofítico, cujos metabólitos, como a cercosporina e isocercosporina, tem potente atividade antimicrobiana e citotóxica (inibição do crescimento de células de câncer de próstata e pulmão).[31] O Pantanal, apesar de ainda ser um bioma pouco explorado com relação aos estudos de fungos endofíticos, tem se destacado como ambiente biodiverso e promissor.
Metodologias para estudar fungos endofíticos: como conseguir acessar esses microrganismos?
Os fungos endofíticos podem ser estudados por metodologias dependentes de cultivo, baseado na obtenção de espécies fúngicas isoladas, ou independentes de cultivo, baseado na análise de genomas, dispensando o isolamento das espécies microbianas.[32] No primeiro caso, após o cultivo das espécies isoladas, fornece metabólitos e enzimas, e ainda podem atuar como controle biológico. Já o segundo método permite estimar um número mais próximo da real diversidade de espécies microbianas (fúngicas, nesse caso) presentes e suas funções fisiológicas, biológicas e ecológicas (Figura 3). Em ambas as abordagens, o primeiro passo é a coleta do material a ser analisado.
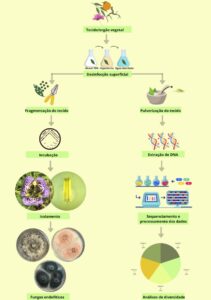
Figura 3. Metodologias para estudos dos fungos endofíticos
(Produção dos autores)
Para isso, o tecido vegetal deve ser saudável, sem sintomas aparentes de doenças, lesões, manchas foliares ou herbivoria. Após a coleta, o material é armazenado em recipiente estéril, identificado e colocado sob refrigeração, transportado e analisado em até 24 horas. Na sequência, é feita a desinfecção superficial para eliminar microrganismos epífitos (microrganismos presentes na superfície dos tecidos vegetais).
O processo de desinfecção usual é com etanol 70% e hipoclorito de sódio (1-2%). O tecido vegetal é primeiro lavado com água corrente e detergente neutro (a depender do tipo de tecido), depois submerso em álcool 70% (1-3 min), em hipoclorito de sódio 1-2% (2-10 min) e, em seguida, é lavado com água destilada estéril. A concentração e tempo de submersão dos agentes desinfetantes irá depender das características do tecido vegetal. A água da última lavagem é transferida para meio de cultura para validar o método de desinfecção de superfície, não devendo ser observado crescimento microbiano.
Para os métodos dependentes de cultivo,[3] após a desinfecção, o tecido vegetal é fragmentado (~2-25 mm2) e colocado em placa de Petri contendo meio de cultura e antibióticos (para evitar o crescimento de bactérias endofíticas), e incubado a 25-30 ºC. Para aumentar a diversidade de espécies isoladas, varia-se, principalmente, as fontes de carbono e nitrogênio do meio de cultura. Os cultivos são observados diariamente e tão logo o crescimento fúngico seja observado, esse microrganismo é coletado com agulhas estéreis e transferido para uma nova placa de Petri contendo meio de cultura fresco. Em seguida, os isolados são subcultivados sucessivamente ou isolados de ponta de hifa, ou monospórico para obtenção de colônias puras, e estas são estocadas. Os isolados, quando possível, são classificados ao nível de gênero baseado na morfologia e tipos de esporos, e ao nível de espécie por meio do sequenciamento genético de regiões características, tidas como barcode (código de barras). Para os métodos independentes de cultivo, o tecido vegetal é pulverizado em nitrogênio líquido até a obtenção de um pó esbranquiçado e o DNA é extraído usando protocolos in house ou kit de extração. O material genético, após ser processado, pode ser analisado para diferentes finalidades, incluindo estudos de diversidade e funcionalidade e atribuição taxonômica (até nível de espécie, quando possível). A partir daí, são feitas inferências funcionais e ecológicas.[3]
Considerações finais
Ao refletirmos o quão limitado ainda é nosso conhecimento sobre a diversidade e o potencial dos fungos endofíticos (e outros microrganismos) presentes nos diferentes biomas brasileiros e como eles tem sido afetado pelas ações antropogênicas, ficam as dúvidas: o que já perdemos sem nem ao menos conhecer? Como os biomas têm sido impactados? Quais potenciais de uso pela humanidade (desde saúde à tecnologia) foram desperdiçados? O que ainda será perdido e como minimizar as perdas futuras?
Saiba mais
Assista ao vídeo sobre os fungos ocultos dos biomas brasileiros:
Capa. A grande diversidade de fungos endofíticos é fundamental para o funcionamento de ecossistemas.
(Foto: Produção dos autores)
CORTELO, Patrícia Cardoso et al. Fungos ocultos dos biomas brasileiros: Microrganismos desempenham funções ecológicas e contribuem para a diversidade nos biomas brasileiros. Cienc. Cult. [online]. 2023, vol.75, n.4, pp.01-09. ISSN 0009-6725. http://dx.doi.org/10.5935/2317-6660.20230055.