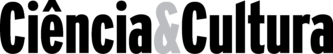A classe dos insetos compreende um dos grupos mais abundantes, diversificados e bem distribuídos existentes na Terra, representando mais de 70% de todas as espécies de seres vivos já descritas.[1,2] Muitos desses representantes pertencentes às ordens Hymenoptera (formigas e abelhas),[3,4] Isoptera (cupins)[5] e Coleoptera (besouros)[6] mantêm relações simbióticas multilaterais com diversos microrganismos que habitam suas colônias para garantir comida e proteção. Um exemplo de interação simbiótica entre inseto e microrganismo é a fungicultura. Essa prática consiste no cultivo e domesticação de um fungo pelo inseto em sua colônia através do constante fornecimento de matéria orgânica para o microrganismo, que, em troca, degrada o material orgânico produzindo nutrientes assimiláveis para o animal.[7] Como existem benefícios para os dois organismos envolvidos na interação, esse tipo de interação é considerada mutualística.
Entre os insetos “agricultores” (também conhecidos como fungicultores), ou seja, que cultivam seu próprio alimento, as formigas pertencentes à tribo Attini (subtribo Attina, subfamília Myrmicinae) se destacam nessa prática há mais de 60 milhões de anos.[8] Essas formigas se originaram na Amazônia [9]e posteriormente se espalharam pela América Central e pelos Neotrópicos,[10] classificadas em 19 gêneros e 245 espécies descritas.[8] Os gêneros mais popularmente conhecidos incluem as formigas saúvas (Atta) e as quenquéns (Acromyrmex), que cortam e utilizam material vegetal fresco, como folhas e flores, como substrato para o cultivo do fungo alimento,[3,13] sendo por isso denominadas formigas cortadeiras. Este fungo, também denominado cultivar, é um basidiomiceto representado por várias espécies da tribo Leucocoprineae, que coevoluiu em um tipo de mutualismo obrigatório com as formigas, vivendo em câmaras específicas (“jardins fúngicos”) dentro da colônia.[13–15] Muitas das espécies de cultivar possuem estruturas especializadas em suas hifas chamadas de gongilídeos. Essas são pequenas protuberâncias esféricas ricas em nutrientes, como carboidratos e lipídeos, que servem como fonte de alimento para as formigas (Figura 1). Esses nutrientes, por sua vez, são provenientes do processamento realizado pelo fungo daquele material orgânico coletado pelas formigas.[16–18]
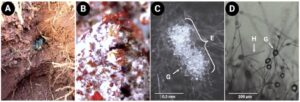
Figura 1. Visão geral do fungo alimento de algumas formigas attina. A. Escavação de formigueiro, pertencente a formigas attina, com exposição do jardim fúngico. B. Imagem ampliada do jardim fúngico, com presença do substrato vegetal e do fungo alimento (branco). C. Estáfila (E) e gongilídeos (G) presentes no fungo alimento após 14 dias de cultivo. D. Microscopia do fungo evidenciando as hifas (H) e os gongilídeos (G).
(Imagem elaborada pelos autores)
Como essas formigas vivem em grandes comunidades, elas possuem uma alta demanda de nutrientes dentro das colônias. Dessa forma, esse ambiente é extremamente vulnerável a infestações por outros microrganismos patogênicos como os fungos filamentosos dos gêneros Trichoderma, Aspergillus, Penicillium e Escovopsis.[19] Escovopsis em particular também coevoluiu com as formigas agricultoras e se especializou em parasitar os jardins fúngicos de suas colônias. Por meio do consumo do cultivar, o fungo Escovopsis diminui a sobrevivência e taxa de reprodução das formigas, podendo causar a destruição completa de uma colônia. Esse patógeno é considerado específico dentro deste contexto, pois não é encontrado de forma livre na natureza, e tem sido isolado apenas do jardim de fungo e das pilhas de lixo das colônias de formigas, em uma relação simbiótica do tipo parasitismo obrigatório.[20–23]
Ao longo de sua evolução, as formigas da subtribo Attina desenvolveram diferentes mecanismos comportamentais e químicos para auxiliar na proteção dos seus ninhos frente à dispersão desses microrganismos invasores. Entre os mecanismos comportamentais pode-se destacar o pré-processamento do material orgânico coletado antes de sua incorporação no jardim de fungos e a constante limpeza deste local. Essa higienização inclui a remoção de esporos patogênicos e de fragmentos infectados do próprio cultivar.[21,24,25] Já os mecanismos químicos, englobam a produção de compostos antimicrobianos produzidos pela formiga e secretados através de suas glândulas metapleurais e fezes.[26–28] Adicionalmente, actinobactérias, especialmente do gênero Pseudonocardia, hospedadas nas cutículas das formigas attina, também são capazes de produzir substâncias bioativas. Esses compostos químicos auxiliam na defesa da colônia contra espécies patogênicas de maneira seletiva, sem prejudicar o fungo alimento, o que torna as actinobactérias mutualistas obrigatórias desse sistema (29–31) (Figura 2).
Figura 2. Relações simbióticas entre microrganismos e formigas attina. As interações mutualísticas são representadas por setas verdes e as barras vermelhas representam interações prejudiciais. As investigações sobre este sistema levaram ao isolamento de diferentes antifúngicos como a attinimicina representada ao centro. A esquerda imagens de formigas apresentando actinobactérias em seus exoesqueletos (A e B) e micrografias das criptas, locais onde as actinobactérias ficam armazenadas (C e D)
(Crédito: Imagens C e D das criptas de “Currie CR et al. Coevolved crypts and exocrine glands support mutualistic bacteria in fungus-growing ants. Science, v. 311, n. 5757, p. 81-83, 2006”. Reimpresso com permissão da AAAS. Imagens A e B elaboradas pelos autores.)
Nesse contexto, o estudo dos microbiomas das formigas fungicultoras pode levar à melhor compreensão da ecologia química envolvida no sistema, ou seja, como os compostos químicos produzidos por microrganismos simbiontes participam da intermediação das interações entre as diferentes espécies envolvidas. Além disso, como esses compostos químicos (produtos naturais ou metabólitos secundários) exercem funções específicas no ambiente natural, eles também podem ter aplicações terapêuticas na saúde humana.
“O estudo dos microbiomas das formigas fungicultoras pode levar à melhor compreensão da ecologia química envolvida no sistema, ou seja, como os compostos químicos produzidos por microrganismos simbiontes participam da intermediação das interações entre as diferentes espécies envolvidas.”
De fato, a descoberta da simbiose entre actinobactérias e formigas attina levou à identificação de compostos biologicamente ativos e estruturalmente diversos. Alguns exemplos incluem dentigerumicinas,[36,37] pseudonocardonas,[38] selvamicina[39] e 9-metoxirebecamicina[40] produzidas por diferentes linhagens de Pseudonocardia. Notavelmente, esses compostos apresentam uma distribuição limitada e não partilham de um padrão estrutural abrangente. Isso pode ser reflexo de uma história evolutiva altamente fragmentada entre as formigas e as linhagens de actinobactérias estudadas até o momento, aliado ao fato de que a maioria dos estudos relatados se refere a simbiontes bacterianos de formigas coletadas na América Central.
Mais recentemente, estudos sobre microbiomas de formigas attina foram realizados no Brasil, envolvendo uma ampla amostragem de formigueiros provenientes de várias regiões brasileiras, incluindo Amazônia, Mata Atlântica e uma região de ecótono desta para o Cerrado. Esses estudos foram conduzidos por uma equipe multidisciplinar integrada em um projeto financiado conjuntamente pela Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) e pelo Fogarty International Center, National Institutes of Health (FIC/NIH), dos Estados Unidos, constituindo o primeiro e único International Cooperative Biodiversity Group (ICBG) no Brasil.[41] Nesse projeto, pesquisadores brasileiros e norte-americanos trabalharam de forma colaborativa desde atividades de coleta de colônias de formigas em parques nacionais e estaduais brasileiros (Figura 3) até os estudos em laboratório, envolvendo métodos microbiológicos, evolutivos, genéticos e químicos.

Figura 3. Trabalhos de coleta do jardim fúngico de diferentes espécies de formigas attina realizados nos biomas de ecótono Cerrado – Mata Atlântica e Mata Atlântica.
(Imagem elaborada pelos autores)
Foram realizadas diversas expedições por esses biomas, e as coletas foram realizadas de forma direta, sem uso de armadilhas, geralmente através da localização dos ninhos das espécies mais evidentes. Assim, foi possível coletar cerca de 393 colônias de formigas da subtribo Attina pertencentes aos gêneros Acromyrmex, Paratrachymyrmex (Trachymyrmex), Atta, Apterostigma, Cyphomyrmex, Mycocepurus, Mycetophylax e outras formigas attina não identificadas.
No Bioma Mata Atlântica, as coletas foram concentradas no Parque Nacional do Itatiaia (Itatiaia, RJ), e cerca de 126 colônias de formigas do gênero Acromyrmex foram recuperadas. Os gêneros Cyphomyrmex (14 colônias), Apterostigma (2 colônias), Paratrachymyrmex (2 colônias) e quatro outros gêneros de attina não identificados também foram coletados. Curiosamente, no estudo de Feitosa e colaboradores (2022)[42] sobre formigas do Brasil, foram reunidas informações num panorama baseado em 50 anos de estudos de diversidade, e foi observado que o gênero Acromyrmex também foi o mais prevalente no bioma Mata Atlântica.
As coletas no bioma Floresta Amazônica foram realizadas no Parque Nacional de Anavilhanas (Novo Airão, AM) e Reserva Ducke (Manaus, AM). Nessas coletas, cerca de 198 colônias de formigas fungicultoras foram recuperadas. Os gêneros mais prevalentes foram Apterostigma (79 colônias) e Paratrachymyrmex (70 colônias). Acromyrmex (10 colônias), Cyphomyrmex (9 colônias) e outras 22 colônias de formigas attina não identificadas também foram recuperadas. Curiosamente, a prevalência dos gêneros Apterostigma e Paratrachymyrmex também foi observada no estudo de Feitosa e colaboradores (2022)[42] para esse bioma.
Na interface de ecótono Cerrado – Mata Atlântica, as coletas foram concentradas principalmente no campus da Universidade de São Paulo em Ribeirão Preto (USP/RP). Cerca de 45 colônias de formigas attina foram coletadas, sendo prevalentes os gêneros Acromyrmex (17 colônias) e Atta (14 colônias), seguidos de Paratrachymyrmex (9 colônias) e Cyphomyrmex (5 colônias). Nesse caso, como se trata de uma área de transição entre dois biomas, não há informações compiladas de formigas agricultoras. Porém, pode-se afirmar que o gênero Acromyrmex é prevalente nos biomas Mata Atlântica e Cerrado. O gênero Atta, por sua vez, também é abundante no bioma Mata Atlântica e Cerrado. Assim sendo, essa prevalência dos gêneros Acromyrmex e Atta nessa interface de ecótono também está segundo o levantamento realizado por Feitosa e colaboradores (2022)[42] (Figura 4).
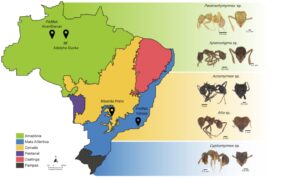
Figura 4. Gêneros de formigas attina mais representativos nas coletas realizadas pelo grupo de pesquisa em diferentes biomas. No bioma Amazônia os genêros Paratrachymyrmex e Apterostigma foram os mais encontrados, no ecótono Cerrado – Mata Atlântica foram os gêneros Acromyrmex e Atta enquanto na Mata Atlântica o gênero Cyphomyrmex se destacou
(Créditos: Mapa do brasil modificado de IBGE [atlasescolar.ibge.gov.br]; imagens das formigas modificadas de Antweb.org/April Nobile. Elaborado pelos autores)
Os microbiomas associados a essa ampla diversidade de formigas foram estudados, e confirmou-se a associação de Pseudonocardia a esses insetos em todos os biomas. Surpreendentemente, os estudos indicaram, pela primeira vez na literatura, a ampla distribuição geográfica de um novo composto chamado attinimicina.[43] Esse peptídeo linear foi detectado em 73% das linhagens de Pseudonocardia associadas a formigas agricultoras coletadas no Brasil.
Inicialmente, análises metabolômicas dos extratos de diversas linhagens de Pseudonocardia coletadas revelaram a presença desse metabólito em ampla ocorrência entre essas amostras. Em seguida, os genomas de algumas linhagens de Pseudonocardia foram avaliados para encontrar o grupo de genes responsáveis pela biossíntese da attinimicina e assim confirmar a sequência de aminoácidos na estrutura química. Posteriormente, primers (pequenos fragmentos de DNA complementares ao material genético que se deseja estudar) foram desenhados para avaliar se esse mesmo grupo de genes estava presente em Pseudonocardia simbiontes de outras espécies de formigas attina provenientes do Panamá. Curiosamente, os genes relacionados à biossíntese da attinimicina só foram encontradas nas linhagens de Pseudonocardia brasileiras. Isso demonstra que possivelmente durante o processo evolutivo dessas formigas de diferentes localidades, elas coevoluíram com subfamílias distintas deste gênero de actinobactéria.
“A descoberta da simbiose entre actinobactérias e formigas attina levou à identificação de compostos biologicamente ativos e estruturalmente diversos.”
A attinimicina demonstrou ser um tipo de sideróforo produzido por Pseudonocardia. Os sideróforos são moléculas produzidas por microrganismos capazes de complexar seletivamente a íons de ferro, para auxiliar na captação e aquisição desse metal, essencial para processos metabólicos vitais.[44,45] Os sideróforos também desempenham um papel crítico em competições por ferro no ambiente, onde diferentes microrganismos competem pela aquisição desse micronutriente escasso.[46,47] Adicionalmente, attinimicina em sua forma livre apresentou atividade antifúngica seletiva contra Escovopsis, mas nenhuma atividade contra o fungo cultivar, exibindo, portanto, atividade antifúngica seletiva contra o patógeno natural das formigas. Com isso, levantou-se a hipótese de que attinimicina poderia ter um papel ecológico na proteção da colônia de formigas contra a dispersão de patógenos.
Para avaliar a possibilidade de produção de attinimicina no ambiente natural e validar a hipótese de seu papel ecológico, novas coletas foram realizadas no Parque Nacional do Itatiaia (RJ) e no campus da USP em Ribeirão Preto (SP). Ao contrário das coletas iniciais, nas quais as bactérias isoladas das formigas foram cultivadas em laboratório e os metabólitos foram extraídos a partir dessas culturas in vitro, nestas novas coletas a extração de fragmentos do jardim fúngico, bem como de formigas operárias, foi conduzida no próprio local de coleta. A detecção in situ dessa molécula foi confirmada por espectrometria de massas em aproximadamente 40% das amostras analisadas, o que corrobora a importância desse composto no contexto ecológico em questão.
Attinimicina também apresentou resultados antifúngicos significativos em ensaios utilizando modelos animais infectados com Candida albicans. Esse patógeno frequentemente acomete humanos, causando lesões em diferentes tecidos, especialmente as mucosas oral e vaginal. O tratamento de camundongos infectados com attinimicina, em sua forma não complexada com ferro, resultou em uma redução da carga fúngica equiparada com fármacos clinicamente relevantes da classe dos azóis.
A ampla distribuição geográfica do conjunto de genes responsáveis pela biossíntese da attinimicina em linhagens de Pseudonocardia spp. do Brasil destaca este composto como o primeiro metabólito especializado produzido por bactérias associadas a formigas attina descrito na literatura. Isso enfatiza a importância da ampla amostragem para estudos da biodiversidade dos biomas brasileiros, realçando o potencial para descoberta de novas moléculas bioativas através da investigação desses ecossistemas únicos que abrigam as formigas attina.
“Attinimicina também apresentou resultados antifúngicos significativos em ensaios utilizando modelos animais.”
Esse maior entendimento da química envolvida na simbiose defensiva em formigas agricultoras no Brasil, e à descoberta de um novo produto natural com ação antifúngica em modelos in vivo, só foi possível graças à equipe multidisciplinar de pesquisadores reunidos no projeto ICBG (FAPESP/FIC-NIH).
Termos utilizados
Microbiota é geralmente definida como o conjunto de microrganismos (bactérias, fungos, protistas, arqueas, algas) vivos presentes em um determinado ambiente.[48]
Microbioma refere-se à comunidade microbiana (microbiota) de um determinado ambiente e toda sua atividade bioquímica, incluindo elementos estruturais (ácidos nucléicos, proteínas, lipídios, polissacarídeos), metabólitos (moléculas de sinalização, toxinas, moléculas orgânicas e inorgânicas) e moléculas produzidas por hospedeiros coexistentes e estruturados pelas condições ambientais do entorno.[49]
Metabolômica é uma abordagem científica que visa uma análise abrangente e quantitativa de todos os metabólitos detectáveis (metaboloma) em um organismo. Pode ser direcionada (target), priorizando a análise de metabólitos específicos conhecidos, ou não direcionada (untarget), buscando uma análise global do perfil químico todos os metabólitos presentes na amostra, incluindo aqueles não identificados previamente. As técnicas analíticas usualmente empregadas para avaliação do metaboloma incluem a ressonância magnética nuclear e a espectrometria de massas.[50-53]
Agradecimentos
Os autores agradecem o apoio financeiro das agências de fomento Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), processos 2013/50954-0 (MTP), 2020/06430-0 (COG), 2015/01001-6 (WGPM), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), processo 307893/2022-7 (MTP). e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001.